|
Добро пожаловать на страницу модельных объектов для нейробиологических исследований, биологии развития и биотехнологий (методов биотестирования и биоиндикации)! В этом разделе нашего сайта вы сможете ознакомиться с рядом видов животных и исследованиями, проводимыми на их нервных и сенсорных системах как на модельных объектах для решения целого круга проблем современной нейробиологии, биологии развития и для разработки новых биотехнологий, в частности, методов биотестирования и биоиндикации. С помощью модельных объектов решают такие важные проблемы нейробиологии как выяснение молекулярных основ рецепции, структурно-функциональных основ интегративных функций мозга, клеточных основ поведения, механизмов, лежащих в основе памяти, обучения и многие другие. На модельных объектах изучают пути и механизмы формирования эволюционного и онтогенетического биологического разнообразия (молекулярные, клеточные, индукционные механизмы, генные системы контроля плана строения, генетический и эпигенетический контроль морфогенезов), постнатальный нейрогенез при нормальном развитии ЦНС, а также при травмах, анализируют влияние повреждающих факторов среды на развитие мозга и сенсорных органов. Важную роль нервные системы модельных объектов играют и в прикладных аспектах. На них изучают действие новых фармакологических препаратов, разрабатывают новые технологии на основе изучения механизмов репарации мозга, устанавливают предельно допустимые концентрации токсических веществ и иных видов загрязнения окружающей среды, разрабатывают новые эффективные методы биотестирования и биоиндикации, используют в качестве уникальных высокочувствительных биосенсоров. Наиболее широко используемыми модельными объектами среди позвоночных животных являются крысы, мыши, собаки, кошки, кролики, лягушки, ряд видов птиц, особенно врановые, и некоторые виды рыб, а среди беспозвоночных – представители аннелид, плоских червей, брюхоногих моллюсков, раки, насекомые (тараканы, стрекозы, саранча, сверчки, мухи, муравьи и т.д.). Большинство используемых в качестве модельных объектов животных являются лабораторными животными или могут относительно долго содержаться и разводиться в лабораторных условиях. Это важное требование связано с необходимостью получения постоянного достаточно генетически однородного биологического материала для опытов. Кроме того, лабораторные животные более стрессоустойчивы к условиям экспериментов и могут содержаться в одинаковых стандартных условиях и на стандартом корме, что способствует получению более достоверных стабильных результатов экспериментов. |
||

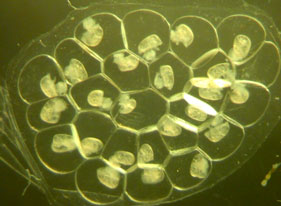
Экспериментальная установка для прижизненного изучения процессов постнатального развития нервной системы рыб в норме и при травмах (мультифотонный конфокальный лазерный микроскоп LCM 780 Meta на базе Axiovert 200M) с камерами для микроманипуляций. Национальный центр Морской биологии ДВО РАН (Владивосток). Фото Е.В. Пущиной и А.А. Вараксина.
|
||

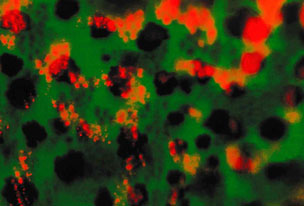
Изучение влияния повышенного фона серотонина на развитие мозга модельного объекта – эмбриона аквариумной рыбки Danio rerio. Повышение концентрации серотонина блокирует дифференцировку серотонинергических нейронов (зеленые) в мозге. Справа – эмбрион после обработки дробящихся бластомеров серотонином. Слева – контроль без обработки серотонином. Фото Е. Ивашкина.
|
||
© Лаборатория эволюционной морфологии (Зоологический институт РАН), ИБР РАН, СПбГУ |
||