Фаллоидин |
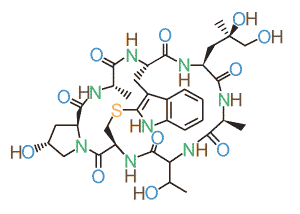
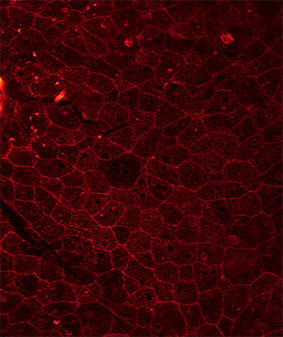
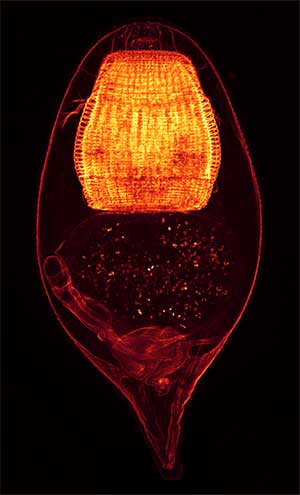
Фаллоидин — бициклический олигопептид (рис. 1), относимый к группе фаллотоксинов — ядов, выделяемых из клеток бледной поганки (Amanita phalloides). Методика окрашивания клеток флуоресцентно меченным фаллоидином была впервые применена в 1979 г. (Wulf et al., 1979) для исследования цитоскелета клеток млекопитающих и с тех пор фаллоидин стал одним из самых популярных красителей в конфокальной микроскопии. Молекула фаллоидина способна избирательно связываться с полимеризованным фибриллярным актином — важнейшим компонентом клеточного цитоскелета. Эта особенность превращает фаллоидин в уникальный инструмент для исследования актина — при ковалентном соединении фаллоидина с флуоресцентной меткой (молекулой флуорохрома) он становится видимым для системы детекции флуоресцентного или конфокального микроскопа и, таким образом, позволяет увидеть расположение актиновых волокон в клетках. Особенную ценность придает фаллоидину то, что он не связывается с рассеянным в клетке глобулярным (мономерным) актином, и поэтому полученная картина распределения актиновых филаментов не «заглушается» фоновым сигналом от глобулярного актина. Поскольку фибриллярный актин является одним из главных компонентов цитоскелета, а у беспозвоночных также и тонофиламентов десмосом (клеточных контактов), окраска фаллоидином позволяет видеть очертания и границы клеток (рис. 2) и поэтому фаллоидин часто используют для выделения контуров клеток во время эмбрионального развития. Однако наиболее важным применением фаллоидиновой окраски стало исследование организации мышечной системы, так как фибриллярный актин наряду с миозином образует сократительную систему мышечных клеток. Если исследуемое животное слабо пигментировано и имеет небольшие размеры, флуоресценцию фаллоидином можно проводить на целом животном (тотальных препаратах), и поскольку исследуемый образец окрашивается целиком, эта методика позволяет воссоздать полную трехмерную картину его мышечной системы (рис. 3). Окраску фаллоидином можно сочетать с флуоресцентной окраской маркеров нервной системы (нейротрансмиттеров, тубулина и т.д.). Такая комбинированная окраска позволяет видеть на препарате одновременно нервные и мышечные волокна и служит источником данных об иннервации мышечной системы. |
|
Автор |
||
Методика окрашивания |
||
Приготовление фаллоидина |
Флуоресцентно меченный фаллоидин, как правило, выпускают в лиофилизированной (высушенной) форме. Для приготовления маточного раствора лиофилизат растворяют (восстанавливают) в метиловом спирте в соответствии с инструкциями производителя. Восстановленный фаллоидин рекомендуется предварительно аликвотировать (расфасовать) в микропробирки и хранить в аликвотированном виде. Лиофилизат и восстановленный в метаноле фаллоидин хранят при -20°C в защищенном от света месте. При таком хранении восстановленный фаллоидин остается стабильным, как минимум, в течение года (как правило, в течение нескольких лет). Чтобы приготовить рабочий раствор, пробирку с аликвотированным маточным раствором оставляют в темном месте с приоткрытой крышкой для испарения метанола (присутствие метанола может повлиять на качество окраски). После испарения метанола фаллоидин разводят на буфере (например, на фосфатно-солевом буфере, 0.01 М PBS). Рабочий раствор может иметь концентрацию по объему от 1:50 до 1:200 в зависимости от вида флуорохрома и условий окраски. |
|
Окрашивание |
Для окрашивания фаллоидином лучше всего подходит фиксация в формальдегиде на буфере (актин разрушается в спиртовых фиксациях и поэтому они не годятся для фаллоидиновой окраски). Поскольку обычный 40%-ный водный раствор формалина содержит химические добавки (в том числе, метиловый спирт), которые могут повлиять на качество окраски, формальдегид готовят разведением параформальдегида (полимеризованного формальдегида) на буфере. Продолжительность фиксации в формальдегиде зависит от характеристик фиксируемого объекта и составляет обычно от 15 минут для отдельных клеток до суток для крупных, плохо проницаемых тканей. Зафиксированный материал несколько раз промывают в PBS. Если в буфер добавлен азид натрия, материал можно продолжительное время хранить на буфере при 6°C. Плазматические мембраны непроницаемы для фаллоидина и поэтому материал перед окраской обрабатывают детергентом (например, 0,25% Triton X-100 на PBS в течение 1-2 часов) для того, чтобы разрушить окружающие клетки плазматические мембраны. Обработку детергентами и все последующие этапы окраски обычно проводят при комнатной температуре, но эти процедуры можно выполнять при любой температуре — от +4°C до +37°C. Для устранения неспецифического фонового сигнала материал можно дополнительно обработать блокирующим буфером (например, 1%-ным альбумином бычьей сыворотки). После обработки детергентом материал инкубируют в фаллоидине. Продолжительность окраски зависит от вида окрашиваемого материала. Для изолированных клеток она может составлять 20 минут, для крупных плохо проницаемых тканей — несколько часов. После окраски материал несколько раз промывают в PBS, помещают в среду для заключения и монтируют на препарат для конфокальной микроскопии. |
|
Комментарии |
|
|