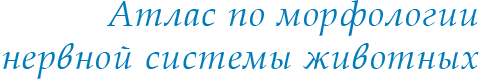
Постэмбриональное развитие нервной |
||
Автор |
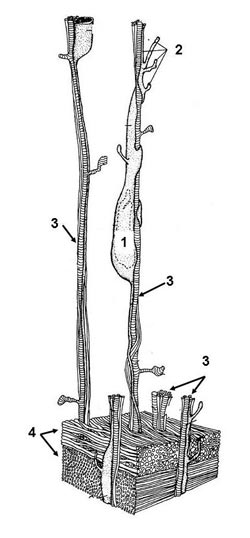
Как вы смогли узнать из раздела «Эмбриогенез», у позвоночных животных и человека в перинатальный период заканчивается формирование общей внутренней структуры мозга, идет активная миелинизация головного и спинного мозга и формируются все основные сенсорные органы. Тем не менее, эти процессы не заканчиваются с рождением. Мозг продолжает расти и увеличиваться в объеме. Показано, что достаточно долго (месяцы и годы в зависимости от размеров тела, продолжительности жизни и систематической принадлежности животного) после рождения происходит дальнейший рост, созревание и дифференцировка нервных структур и проводящих трактов. У человека наиболее интенсивный рост мозга идет в течение первых двух лет жизни и к двум годам его вес достигает примерно 70% веса мозга взрослого человека. В основном увеличение мозговой массы происходит не за счет образования новых клеток (после рождения их количество мало увеличивается), а в результате роста их отростков и их миелинизации. Эти процессы приводят к образованию новых связей и эффективности проведения нервных импульсов. У двухлетнего ребенка в коре больших полушарий нервные клетки расположены дальше друг от друга, чем у новорожденного, за счет увеличения между ними нервных отростков. Это приводит к увеличению площади коры. К двум годам она увеличивается приблизительно в 2.5 раза, причем в основном путем углубления извилин. Увеличивается также толщина коркового слоя больших полушарий. Мозжечок у новорожденного развит слабо, имеет продолговатую форму, малую толщину и неглубокие борозды, но растет очень интенсивно. Если в коре больших полушарий клеточные слои, характерные для мозга взрослого человека, формируются уже к шестому месяцу эмбрионального развития, то слоистое строение коры мозжечка начинается образовываться только после рождения и заканчивается к 9–11-му месяцам жизни. К концу второго года жизни вес мозжечка увеличивается почти в 5 раз по сравнению с его весом сразу после рождения. Интенсивное формирование мозжечка уже после рождения связано напрямую с его функцией – координацией двигательных реакций и в том числе поддержания нормального положения тела. Эти функции мозга становятся необходимы к концу 1-го года жизни только после приобретения первых навыков осознанного движения в пространстве: хватательных движений, сидения, стояния, ходьбы. Регуляция положения тела в пространстве невозможна без развития проприоцептивной сенсорной системы. Проприоцептивная сенсорная система связана с рецепторами скелетно-мышечного аппарата. Проприорецепторы дают информацию о каждом движения – положении суставов, длине и напряжении мышц, участвующих в двигательном акте, степени натяжения сухожилий и т. д. Поскольку скелетно-мышечный аппарат является исполнительной системой организма, проприоцепция обеспечивает обратную связь в осуществлении движений. Наряду с системой вестибулярной чувствительности проприоцептивная система дает информацию о том, как организм вписывается в окружающую среду и насколько эффективно он взаимодействует с ней. В процессе онтогенеза формирование проприорецепции начинается с 1–3 месяцев внутриутробного развития. К моменту рождения проприорецепторы и корковые отделы достигают высокой степени зрелости и способны к выполнению своих функций. Особенно интенсивно идет совершенствование всех отделов двигательного анализатора до 7 лет. Сходные процессы в развитии мозга и сенсорных систем можно наблюдать и у позвоночных животных. В ювенильный период онтогенеза мозг интенсивно растет и дифференцируется. Клеточное строение многих отделов мозга у новорожденного значительно отличается от взрослого. Нейроны новорожденных еще не имеют характерную для определенных нервных центров форму, размеры и количество отростков. У человека к трем годам жизни масса головного мозга по сравнению с массой его при рождении утраивается, к 5 годам она составляет 1/13–1/14 массы тела. К 20 годам первоначальная масса мозга увеличивается уже в 4–5 раз, однако составляет у взрослого человека уже всего 1/40 массы тела, поскольку на смену первоочередному и интенсивному росту мозга приходит рост тела. К 17–18 годам морфологическое развитие больших полушарий мозга у человека в целом завершается, однако функциональное совершенствование мозга продолжается у человека и животных на всем протяжении их жизни. Более того, оказалось, что во взрослый период онтогенеза позвоночных может также происходить образование новых нейронов и глиальных клеток за счет сохранения в мозге популяций нервных стволовых клеток (НСК). Обновление рецепторных клеток в сенсорных органах идет постоянно в течение всей жизни позвоночных животных и человека, хотя с возрастом оно обычно замедляется. В сетчатке глаз идут постоянные процессы физиологической регенерации рецепторных клеток (палочек и колбочек). Например, у человека процесс обновления каждой палочковой клетки длится 9–12 суток. Обновление рецепторных обонятельных клеток у млекопитающих в постнатальном онтогенезе происходит в течение 30 суток. В конце жизненного цикла первичночувствующие обонятельные клетки подвергаются деструкции. Камбиальными элементами обонятельного эпителия являются малодифференцированные клетки базального слоя. Они лишены отростков и способны митотически делиться. В процессе их дифференцировки увеличивается их объем, появляются специализированные отростки. Дендрит растет к поверхности эпителия. На его булавовидно расширенной апикальной поверхности формируются характерные чувствительные цилии (обонятельные реснички) или микроворсинки (в зависимости от вида животного или разновидности обонятельного органа), аксон уходит под эпителий к обонятельным луковицам – обонятельные нервные центры гломерулярного типа строения. Во вкусовых луковицах сосочков языка обновление рецепторных клеток и поддерживающих (опорных) происходит примерно с интервалом в 10 суток. Источниками новых клеток являются расположенные в основании луковиц камбиальные малодифференцированные клетки. Обновление рецепторных клеток в органе слуха выявлено не у всех животных. Интересно, что у многих видов птиц рецепторные клетки органа слуха прекрасно восстанавливаются в случае повреждения. Причем эта способность сохраняется у них на протяжении всей жизни. Самый распространенный способ, благодаря которому осуществляется регенерация волосковых клеток органа слуха птиц – это деление опорных клеток, окружающих поврежденные рецепторные клетки (рис. 1). Поколение получившихся при этом делении клеток дифференцируется в новые волосковые и опорные клетки. Существует равная вероятность того, что новые клетки превратятся в опорные или волосковые. Это означает, что бывают случаи как симметричной дифференцировки, при которой появляются 2 рецепторные или 2 опорные клетки, так и асимметричной, при которой образуется одна опорная и одна рецепторная клетка. В результате этих процессов достигается исходное соотношение численностей и регулярный порядок взаиморасположения клеток слухового эпителия. Другой способ восстановления волосковых клеток – это «фенотипическая конверсия» или прямая трансдифференциация. При этом опорные клетки превращаются прямо в рецепторные, не вступая в митоз. Высказано предположение, что не все опорные клетки слухового эпителия птиц одинаковы и какая-то их часть может пройти при определенных условиях через неоднократное деление, а часть может вступить в прямую трансдифференциацию. Интересно, что в процессе регенерации слухового эпителия дифференцирующиеся волосковые рецепторные клетки проходят серию морфологических изменений и перемещений, при этом их местонахождение относительно базальной мембраны в эпителиальном пласте меняется. Па первых стадиях дифференцировки (14–24 часа после повреждения рецепторных клеток) клетки имеют округлую или слегка веретенообразную форму и остаются поблизости от апикальной поверхности эпителия, куда они приходят в ходе митоза. На промежуточной стадии дифференцировки (через 2–4 дня) новые рецепторные клетки напоминают по форме опорные: они вытягиваются в длину и доходят до апикальной и базальной поверхностей эпителия. На поздней стадии дифференцировки (спустя 7 дней) клетки вновь теряют связь с базальной мембраной и приобретают форму и расположение зрелых рецепторных клеток, уходя вновь к поверхности эпителия. Таким образом, дифференцирующиеся слуховые клетки вначале уходят в верхнюю часть эпителиального пласта, затем вытягиваются на всю его высоту, потом возвращаются к апикальной поверхности. Соответствующие перемещения происходят и с их ядрами. Интересно, что в стенке эмбрионального мозга в ходе пролиферации и дифференцировки нервные стволовые клетки также претерпевают относительно сходные морфологические изменения, связанные с последовательными перемещениями в нервной трубке (см. рис. 6, раздел «Эмбриогенез»). |
Содержание
Рис. 1. Cпособы восстановления волосковых клеток после повреждения (по: Stone, Cotanche, 2007).
A – зрелый слуховой эпителий без повреждений. B – прямая трансдифференциация опорных клеток с превращением в волосковые (показано стрелкой). C – деление опорных клеток с последующей дифференциацией части дочерних клеток в волосковые (показано стрелками) |
Рекомендуемая литература |
|
|
Нейрогенез во взрослой нервной системе |
||
АвторыЕ.В. Пущина, Д.К. Обухов, А.А. Вараксин Редактор О.В. Зайцева |
В конце двадцатого века был выявлен процесс постнатального нейрогенеза в структурах центральной нервной системы позвоночных животных и человека, что кардинально изменило представления о возможностях нервной ткани к формированию, обновлению и регенерации. В связи с чем возникла необходимость пересмотра известной фразы – «нервные клетки не восстанавливаются». |
|
Нейрональные стволовые клетки и их потомки |
Было установлено, что во взрослом мозге сохраняются группы камбиальных клеток. Они являются потомками нейрональных стволовых клеток (НСК) и способны к пролиферации и дифференцировке в зрелые элементы нервной ткани. Образующиеся из них молодые нейро- и глиобласты мигрируют из пролиферативных зон в различные районы мозга, дифференцируются и встраиваются в зрелые нейронные структуры. НСК относятся к группе тканеспецифичных или региональных стволовых клеток. Они обладают характеристиками самоподдерживающейся популяции клеток, которые при выходе в дифференцировку способны давать нейроны, астроциты и олигодендроциты не только в развивающемся, но и во взрослом мозге. Впервые они были обнаружены в центральной нервной системе человека в 1995 г. при анализе посмертных срезов мозга, окрашенных иммуногистохимически на BrdU (бромдезоксиуридин) – один из маркеров пролиферации. В настоящее время найден целый ряд иммуногистохимических маркеров, которые позволяют более или менее надежно идентифицировать НСК и их потомков. Среди них следует отметить: ядерный антиген нервных клеток (нейрогенин) – NeuN, ядерный маркер нейрональной дифференцировки (HuCD), маркер нейробластов – даблкортин (DCX), нейрон-специфическую энолазу – NSE, молекулы адгезии нервных клеток – PSA-NCAM, цитоскелетные белки – нестин, β-тубулин III, транскрипционные факторы – Sox-1, Sox-2, Dlx2, Pax 6 и ряд других. Выявление НСК как в развивающемся, так и во взрослом мозге поставило вопрос об их происхождении. В ранний период эмбрионального развития НСК матричного слоя нервной трубки дают начало нейронам, глиальным клеткам, а также популяции клеток-предшественников, которые включаются в процессы нейро- и глиогенеза на более поздних этапах развития, включая постнатальный период. На роль такой «поздней» клетки-предшественницы в пренатальном и в постнатальном периодах развития претендует так называемая «радиальная глия – RG». Она является прямым потомком НСК, располагается в матричном слое нервной трубки и имеет отросток, пронизывающий всю толщу развивающейся стенки нервной трубки, служащий в качестве направляющей для миграции молодых нейробластов (рис. 2). Считалось, что по окончании нейрогенеза радиальные клетки в развивающемся мозге млекопитающих трансформируются в астроциты. Однако оказалось, что радиальные клетки не только обеспечивают миграцию вновь образованным нейронам, но и сами способны участвовать в процессах нейро- и глиогенеза. Иммунологически в клетках радиальной глии помимо маркеров, традиционных для глиальных клеток (ГКФБ, виментин, нестин), выявляются специфические маркеры. Одним из таких маркеров является фермент ароматаза В и GLAST – глутаматный транспортер (рис. 3). Кроме того, в RG-клетках помимо AroB, выявляется активность TH – тирозингидроксилазы, NADPH-диафоразы, GABA – гамма-аминомасляной кислоты и NuCD – протеина (традиционно нейрогенных маркеров), что является уникальным явлением, позволяющим выделить линии глиальной и нейронной дифференцировки при развитии мозга. Пролиферативные потенции клеток радиальной глии оцениваются по наличию PCNA – ядерного антигена пролиферации и мечением BdU – бромдезоксиуридином. Для радиальной глии также характерна экспрессия полисиаловой молекулы адгезии нервных клеток (PSA-NCAM) и ряда транскипционных факторов. Таким образом, во взрослом мозге позвоночных животных и человека сохраняются группы клеток-предшественников, которые обладают свойствами стволовых клеток и способны в течение длительного периода обновлять популяции нейронов и глии. |
|
Зоны постнатального нейрогенеза |
Участки в центральной нервной системе, где были обнаружены НСК, располагаются у представителей разных групп позвоночных животных в разных отделах головного мозга. У млекопитающих животных и человека – это субгранулярная зона в зубчатой извилине гиппокампа и субвентрикулярная зона в районе латеральных желудочков конечного мозга (рис. 4А). Скорость увеличения числа новых клеток в зубчатой извилине гиппокампа взрослого мозга определяется как 9000 единиц в течение суток, что составляет примерно 6% от общего количества нейронов в зубчатой фасции гиппокампа крысы или около 250 тысяч в месяц. У кролика в сутки в обонятельной луковице образуется приблизительно 30–80 тысяч нейронов, что составляет примерно 1% от всей популяции гранулярных нейронов этого отдела мозга, а в зубчатой фасции гиппокампа – 9 тысяч нейронов, что составляет 0,03% от общего числа ее нейронов. В последнее время появились данные, что постнатальный нейрогенез у млекопитающих может происходить и в неокортексе. У рептилий и птиц субвентрикулярные нейрогенные зоны в конечном мозге более обширны, чем у млекопитающих, и молодые нейроны и глиальные клетки из этих пролиферативных зон расселяются во многие отделы мозга: обонятельную луковицу, во все зоны кортикальной пластинки, в стриатум и мозжечок. У амфибий пролиферативные зоны еще более обширны, чем у амниот. Они были обнаружены в конечном, промежуточном, среднем мозге, мозжечке и спинном мозге. Относительно интенсивности постнатального нейрогенеза показано, что у высших млекопитающих он идет довольно медленно и с возрастом быстро угасает. Отмеченное снижение происходит довольно рано и нейрогенез поддерживается на очень низком уровне. У других позвоночных животных, особенно у амфибий и рыб, нейрогенез идет более интенсивно и продолжается практически всю жизнь. Исследование постнатальной пролиферации, проведенное на двух видах рыб, Apteronotus leptorhynchus и Danio rerio, показало, что примерно за 30 минут в их мозге образуется около 6000 новых клеток, что составляет примерно 0,1–0,2% от общего количества клеток их головного мозга. |
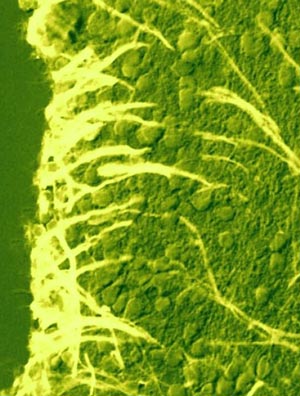
Рис. 3. Иммуногистохимическое выявление ароматазы В в клетках радиальной глии в субвентрикулярной области промежуточного мозга лосося – симы Onchorhinchus masou Br. (по: Puschina et al., 2017, 2018).
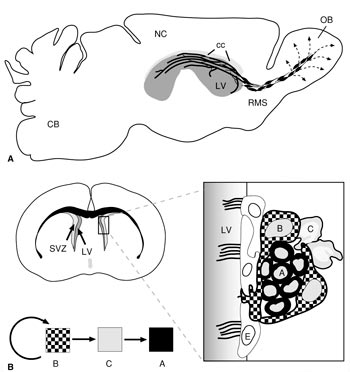 Рис. 4. Организация пролиферативных зон (А) и нейрогенной ниши (Б) в центральной нервной системе взрослых млекопитающих (крыса) (по: Neurogenesis in the adult brain, 2014).
OB – обонятельная луковица; СВ – мозжечок; СС – мозолистое тело; NC – неокортекс; LV – латеральный мозговой желудочек; RMS – путь миграции нейробластов в обонятельную луковицу; SVZ – субвентрикулярная пролиферативная зона; А – нейробласт; В – клетка-предшественник (радиальная глия); С – промежуточная форма; Е – клетки эпендимы |
Нейрогенная ниша |
Нейрональные стволовые клетки и их потомки – находятся в тесном взаимодействии со многими элементами окружающей их структуры мозга, формируя вместе с ними своеобразную нейрогенную нишу (stem niche). В ее составе выделено несколько типов клеток (рис. 4Б). Клетки А-типа являются нейробластами, начинающими миграцию в толщу стенки мозга; клетки В-типа являются клетками радиальной глии, а клетки С-типа рассматриваются как промежуточные клеточные формы в процессе нейрогенеза. Помимо них в состав нейрогенной ниши входят клетки эпендимы выстилки мозговых желудочков, астроциты, олигодендроциты, эндотелий капилляров мозга и компоненты межклеточного матрикса. Клетки «ниши» способны экспрессировать целый ряд факторов, необходимых для сохранения популяции НСК и регуляции нейро- и глиогенеза. Среди факторов, влияющих на нейрогенез, следует отметить целую группу транскрипционных факторов – Shh, Sox1, Sox2, Tbr1, Wnt, BMP, Notch1, Pax6 и др. Они действуют на разные стадии нейро- и глиогенеза, причем часто прямо противоположно. Например, транскрипционные факторы Notch1 и BMP подавляют нейрональную дифференцировку, направляя развитие клеток предшественников в глиальном направлении, а фактор Trb2 наоборот стимулирует нейрогенез. Фактор Shh (sonic hedgehog) и транскрипционные факторы из семейства Sox регулируют процесс пролиферации клеток-предшественников. Эти факторы могут влиять и на другие этапы нейро- и глиогенеза, проходящие в пролиферативных зонах (миграцию нейробластов, образование определенных типов клеток, формирование отростков у нейронов, развитие синаптических связей). Разнообразные ростовые факторы (эпидермальный фактор роста – EGF, трансформирующий фактор роста – TGFa, основной фактор роста фибробластов – bFGF, инсулиноподобный ростовой фактор – IGF1, фактор роста эндотелия – VEGF; интерферон гамма – IFN-γ и др.) также влияют на пролиферацию и дифференцировку клеток-предшественников. Особое место среди сигнальных молекул занимают нейромедиаторы и нейромодуляторы. Дело в том, что нейроны вскоре после образования из клеток-предшественников и задолго до начала миграции и формирования межнейрональных связей начинают секретировать молекулы нейромедиаторов, которые оказывают существенное влияние на развитие клеток в течение эмбриогенеза, а также в ходе постэмбрионального нейрогенеза. Например, допамин, норадреналин и ГАМК регулируют процессы дифференцировки клеток в нейрогенных зонах мозга. Другие нейромедиаторы (глутамат и ацетилхолин) существенно влияют на выживаемость молодых нейронов, причем их действие противоположно (глутамат отрицательно влияет на выживаемость клеток, а ацетилхолин – положительно). В последнее время особое внимание уделяется роли газообразных посредников (NO, H2S, CO) в регуляции процессов нейрогенеза в пре- и постнатальном периодах развития ЦНС. Было показано, что они существенно влияют на процесс миграции нейробластов, рост аксонных и дендритных ветвлений, пролиферацию и апоптоз НСК и их потомков в нейрогенных нишах и за их пределами. Большое влияние на пролиферативные ниши оказывают внешние, эпигенетические факторы (стресс, депрессия, нарушения кислородного и других обменных процессов в нервной ткани, ряд физических агентов и возраст). Клетки «ниши» сами способны экспрессировать морфогенетически важные факторы и сигнальные молекулы, а также белки внеклеточного матрикса, необходимые для сохранения как самих стволовых клеток, так и для регуляции пролиферации, миграции и дифференцировки их потомков. Предполагается, что эти сигналы могут поступать от эндогенных источников (от самих элементов «ниши») и/или от экзогенных источников (кровеносной системы и черепно-мозговой жидкости). |
|
Низшие позвоночные как модельные объекты постнатального нейрогенеза |
В связи с рядом особенностей постнатального нейрогенеза у низших позвоночных животных, и особенно у рыб, они оказались удобными объектами для изучения процессов нейрогенеза в норме и в эксперименте. Во-первых, у рыб выявлено несколько пролиферативных зон в структурах взрослого мозга, которые располагаются вдоль всей ростро-каудальной оси нервной системы (от конечного до спинного мозга). Важно подчеркнуть, что расположение пролиферативных зон соответствует нейромерной (сегментарной) организации закладки нервной системы, что подтверждается выявлением зон экспрессии транскрипционного фактора Pax 6, связанного с контролем сегментации ЦНС животных. Во-вторых, в зависимости от области мозга, новые клетки могут как оставаться рядом с областью, где они появились, так и мигрировать в течение 1–2 недель после их образования в определенные районы головного и спинного мозга на довольно большие расстояния. В-третьих, нейрогенез у рыб идет более интенсивно по сравнению с высшими позвоночными и продолжается практически всю жизнь (рис. 5). 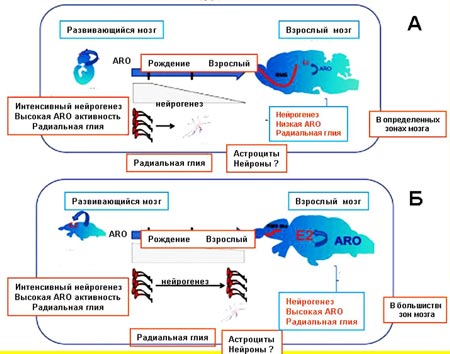
Рис. 5. Сравнительная схема процессов пре- и постнатального нейрогенеза в центральной нервной систем высших (А) и низших (В) позвоночных животных (по: Pellegrini et al., 2007, с изменениями)
Четвертой особенностью постнатального нейрогенеза в мозге рыб в норме и при травме мозга является элиминация большого числа клеток путем апоптоза, тогда как у млекопитающих при повреждении мозга происходит активация макрофагальной микроглии, что приводит к развитию воспалительной реакции и расширению области повреждения мозга. Несмотря на эти особенности, рыбы оказались удобным объектом для исследования процесса постнатального нейрогенеза в норме и в эксперименте (травма мозга). Изучение последствий травмы мозга показало, что она сопровождается определенным усилением нейрогенеза в пролиферативных зонах и миграцией молодых клеток в зону повреждения. На молоди нескольких видов рыб были поставлены эксперименты, в ходе которых в разных структурах мозга наносили механическую травму (зрительный нерв, крыша среднего мозга, полушария конечного мозга). При механическом повреждении у рыб этих отделов мозга с помощью иммуногистохимического маркирования PCNA (пролиферативного ядерного антигена), транскриптационного фактора Pax6 и серии других маркеров было выявлено усиление пролиферативной активности как в традиционных пролиферативных зонах нейрогенеза (перивентрикулярные области), так и зафиксировано появление новых нейрогенных участков. Таким образом, после механической травмы в мозге экспериментальных животных источником новых нейронов являются появляющиеся в пролифератиных областях мозга новые зоны вторичного нейрогенеза. Процесс репарации после нанесения механической травмы начинается с апоптоза поврежденных элементов. Апоптотический ответ наблюдается уже через полчаса после нанесения повреждающего воздействия и продолжается до 21 дня после травмы. Эти данные подтверждены результатами маркирования TUNEL-позитивных фрагментов ДНК в зоне повреждения, а так же данными электронно-микроскопического анализа. Прижизненный мониторинг клеток в зоне повреждения с помощью мультифотонной конфокальной микроскопии показал, что уже через час после повреждающего воздействия наблюдается физиологический ответ со стороны макрофагов и микроглии, которые мигрируют в область нанесения механической травмы и активно участвуют в элиминации поврежденных клеток с помощью фагоцитоза. Однако, в отличии от млекопитающих, воспалительная реакция в нервной ткани у низших позвоночных животных (рыб) быстро угасает и не формируется глиальный рубец и нервная ткань начинает восстанавливаться. Дифференцировка клеток в нейрональном направлении, обнаруженная при помощи маркирования клеток антителами против белка HuC/D, происходила в пролиферативных зонах теленцефалона, зрительного тектума, мозжечка и продолговатого мозга форели уже через 2 дня после травмы. Эти исследования могут послужить основой для дальнейших исследований особенностей постнатального нейрогенеза в ЦНС животных и человека в норме и при патологии. Таким образом, можно считать, что «нервные клетки во взрослом организме не делятся, но восстанавливаются за счет сохранения в структурах центральной нервной системы участков с нервными стволовыми клетками, способными к пролиферации и дифференцировки в новые популяции нейронов и глиальных клеток». |
|
Рекомендуемая литература |
|
|