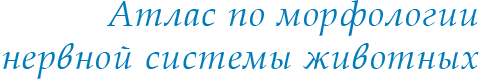
Прижизненные методы исследования нервной системы |
||
АвторыО.С. Сотников |
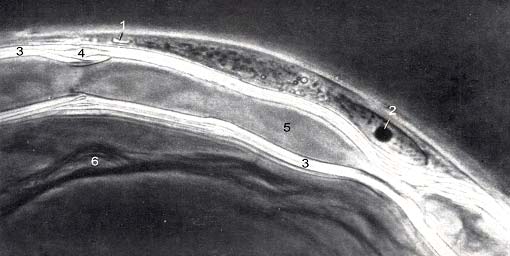
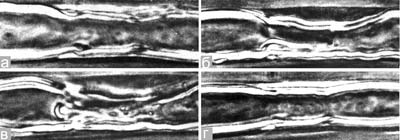
Этот раздел методов изучения нервной системы точнее было бы назвать: «Морфологическая физиология живой нервной системы». Действительно, прижизненные микроскопические исследования находятся на грани морфологии и физиологии. Жизнь невозможна без движений и превращений. Все остальные, предлагаемые вашему вниманию на нашем сайте методики, базируются на выявлении и контрастировании геометрии и химии уже зафиксированных тканей на статических гистологических препаратах. Прижизненная же нейроморфология основывается на кинетике морфологических процессов, прямом, во времени, изучении материальной жизни клеток и тканей. В этом состоит принципиальное отличие представляемых в этом разделе методик. Морфология каждой конкретной живой нервной клетки не представляет собой что-то постоянное. Живой нейрон не только в культуре, но и в живом организме может при определенных условиях менять свою форму, образовывать отростки и втягивать их, менять их форму, длину и характер ветвления, изменять контакты с другими клетками, образовывать новые синапсы, перемещаться путем передвижения содержащей ядро части (своего тела) внутри одного из своих отростков с последующем втягиванием отростка в тело, расположенное уже в другом месте (см. пример – Эмбриогенез позвоночных в разделе Онтогенез) и т.д. Рецепторные клетки способны в ходе своей жизнедеятельности постоянно обновлять свой рецепторный аппарат – терминальные участки своих чувствительных отростков, формировать разрушающиеся в ходе функционирования цилиарные структуры (реснички, жгутики) и микроворсинки. Особенно все эти процессы выражены при формировании нервной системы в ходе онтогенеза организма и в случае различных повреждений при репарации, включая функциональную репарацию. Способность нейронов менять свою форму напрямую связана с удивительной текучестью нейроплазмы и постоянным движением аксоплазмы, которое одновременно идет и к телу и от тела клетки по ее отросткам. Наблюдение за током аксоплазмы легко осуществляется при изучении сокращения аксонов, лишенных оболочек. Нейроплазма перемещается в составе растущего и ретрагирующего отростка как единое целое. Первые прижизненные нейроморфологические оптические исследования были проведены первым микроскопистом Антони ван Левенгуком (A. Leeuwenhoek. Odservations in nervos. Opera omnia. 1719, v.4, p. 348–360). Самым распространенным и удобным прижизненным способом микроскопии по праву считается метод фазово-контрастной микроскопии, предложенной нобелевским лауреатом, физиком Фрицем Цернике в 1933 г. на физиологическом медицинском конгрессе в г. Вагенингене. Фазово-контрастный микроскоп значительно повышает контрастность объектов, проницаемых для света. С помощью этого метода могут быть исследованы без предварительной обработки бесцветные, прозрачные объекты, детали, строение которых оптически мало различаются между собой. Для работы по методу фазового контраста нужно кроме обычного биологического микроскопа иметь еще специальные устройства: фазовые конденсор и объектив. Рис. 2. Полный комплекс всех структур одиночного миелинового волокна лягушки Rana temporaria в норме. Фазовый контраст (по: Сотников, 2016). 1 – цитоплазма глиальной Швановской клетки и 2 – ядрышко в ее ядре; 3 – миелиновая оболочка; 4 – насечка Шмидта-Лантермана; 5 – осевой цилиндр (аксон); 6 – коллагеновые волокна.
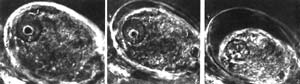
Существуют и другие, реже применяемые методы, основанные на различных физикооптических приемах контрастирования, например цветной интерференционный контраст (рис. 5, 6, 7). Для таких исследований необходим специальный интерференционный микроскоп. Рис. 5. Нейрон, изолированный из нервной системы брюхоногого моллюска Lymnaea stagnalis, в культуре ткани (среда RPMI-1640). Цветной интерференционный контраст (по: Сотников, 2016). 1 – дендриты-невидимки (истонченные отростки, которые не имеют достаточной для визуализации оптической плотности); 2 – отросток, образующий кольцевой аутапс (контакт нейрона «на себя»); 3 – колба ретракции (место втягивания отростка).
Наиболее простым способом контрастирования и визуализации живых препаратов являются боковое освещение и методика Номарского. Они легко реализуются при всевозможных смещениях конденсора или фазового кольца. Более сложными являются: темнопольная микроскопия (ультрамикроскопия), допускающая нестандартное разрешение (по Аббе – 0.2 мкм) и позволяющая наблюдать мелкие элементы с диаметром до 0.1 нм (рис. 8). Интерференционная микроскопия позволяет определять плотность вещества живого субстрата (в основном концентрацию белка). Используется также и аноптральная микроскопия. Работа аноптрального микроскопа основана на принципе так называемого амплитудного контраста. Метод аноптрального контраста является усовершенствованием метода фазового контраста. Преимуществом метода аноптральной микроскопии является большая разрешающая способность объективов и возможность выявления минимальных оптических разностей плотности в неокрашенных препаратах (рис. 9). Чем больше оптическая плотность объекта, тем светлее его изображение. Для прижизненных исследований может быть использовано наконец и кратковременное прижизненное (не суправитальное, которое используется в нейрогистологии, см. раздел «нейрогистологические методы») окрашивание нервных структур красителем метиленовым синим (рис. 10). Этот краситель обладает низкой токсичностью и, проникая в живые нервные клетки, через некоторое время обесцвечивается за счет перевода его в бесцветную нетоксичную форму. Рис. 10. Метод окраски 0.2% метиленовым синим живого интактного мочевого пузыря лягушки без фиксации (по А.С. Догелю)
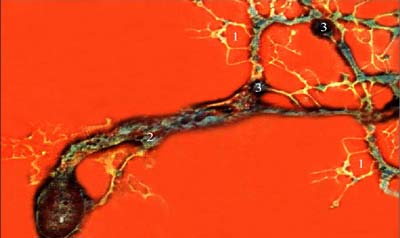
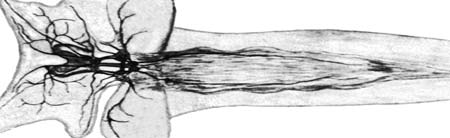
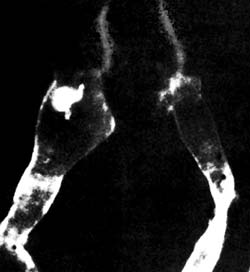
При всем многообразии способов наблюдения прижизненной динамики объектов все эти методы не могут быть применены для любого объекта. Их можно использовать только на прозрачных животных, органах или клетках, например, для изучения двигательных нервных терминалей безмиелиновых нервных волокон или некоторых рецепторных клеток, изолированных нейронов, на прозрачных личинках многих беспозвоночных и т.п. Для длительного прижизненного изучения элементов нервной системы наиболее удобны выделенные нервные сплетения моллюсков, диссоциированные гидроиды, нервные сплетения вегетативной нервной системы позвоночных животных и т.п. (рис. 11, 12, 13). Второй особенностью методов является необходимость использования подвижного временного регистрирующего прибора: типа цейтраферного киноаппарата или видеосъемки. Фото О.С. Сотникова Рис. 11. Интактный препарат прозрачного тела моллюска Lymnaea stagnalis. Видны основные ганглии центральной нервной систем и нервы (темные). Фазовый контраст.
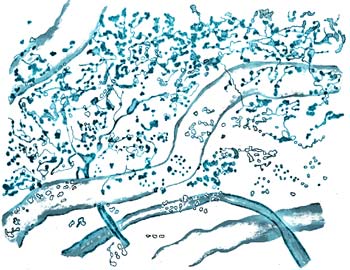
Рис. 12. Обратимые и неспецифических изменения перехватов Ранвье при нарушении гомеостаза. Расщепление щели миелина перехвата. Прижизненная цейтраферная видеосъемка. Фазовый контраст (фото Сотникова).
Рис. 13. Неспецифические и обратимые изменения перикариона шванновской клетки при любых нарушениях гомеостаза. Фазовый контраст (фото Сотникова).
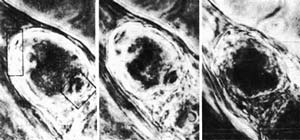
Достоинствами прижизненных методов является отсутствие необходимости подвергать объект перед исследованием токсической обработке фиксирующими растворами, применяемыми во всех других методах исследования тканей, чтобы избежать посмертных изменений в их структуре. Однако сама эта обработка, сопровождающаяся быстрым удалением воды из исследуемой ткани, приводит к значительным морфологическим изменения, особенно в нежных нервных структурах (рис. 14, 15). Рис. 14. Последовательные (слева направо) изменения живого вегетативного нейрона лягушки при фиксации этиловым спиртом. Киносъемка (фото Сотникова).
Рис. 15. Динамика изменений (слева направо) живого вегетативного нейрона лягушки при действии 2.5% глутаральдегидом. Цейтраферная киносъмка (фото Сотникова).
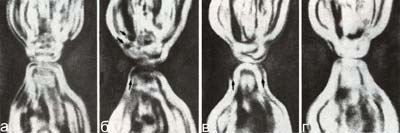
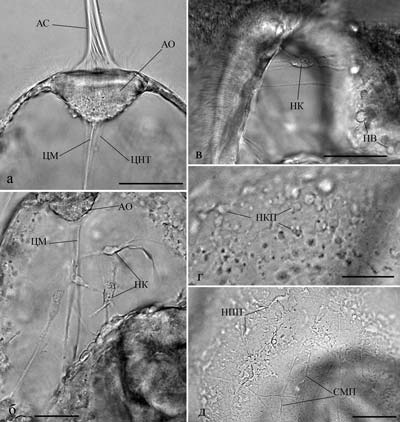
Прижизненные исследования на изолированных элементах нервной системы и на живых организмах позволяют понять какие морфологические структуры отражают те или иные процессы, происходящие в нервной системе. Оказалось, что эти процессы носят универсальный для всех типов животных характер и сопровождаются сходством морфологических структур в онтогенезе и филогенезе (Сотников, 2008; Зайцева, 1998, 1999, 2000, 2004, 2016; Зайцева, Флячинская, 2010). Так например, лапковидная уплощенная структура на конце нервного отростка представляет собой конус роста отростка как у нейронов в культуре ткани, так и в живом организме разного уровня организации и систематического положения (рис. 16, 17). Рис. 17. Элементы нервной системы пилидия немертины размером 360 мкм (б), 500 мкм (г) и 600 мкм (а, в, д): а – апикальный орган с отходящими от него центральным нервным трактом и центральным мускулом; б – нервные клетки в куполе вокруг центрального мускула; в – нервные элементы, расположенные в стенке глотки и желудка и между ними; г, д – последовательные стадии формирования нервного сплетения кожных покровов. Реконструкция на основе послойной прижизненной микрофотосъемки. Масштаб 50 мкм. АО – апикальный орган, АС – апикальный султанчик, НКП – нервные клетки покровов, СМП – субэпидермальный мышечный плексус, Э – эпидермис, остальные обозначения как на рис. 16 (по Зайцева, Флячинская, 2010).
Рис. 19. Разновидности ламеллярных отростков нейронов: а–в – шипиковидные выпячивания филоподий конусов роста по краю ламеллы, г – ламелла в виде расширенного конуса роста. Указано время от начала посадки в культуру. Фазовый контраст (по: Сотников, 2008).
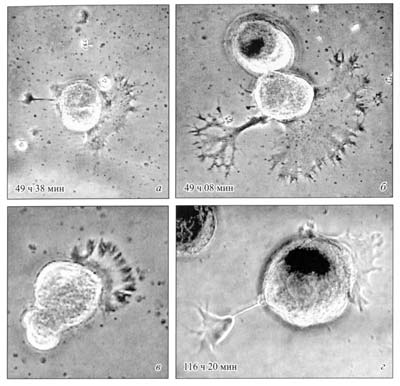
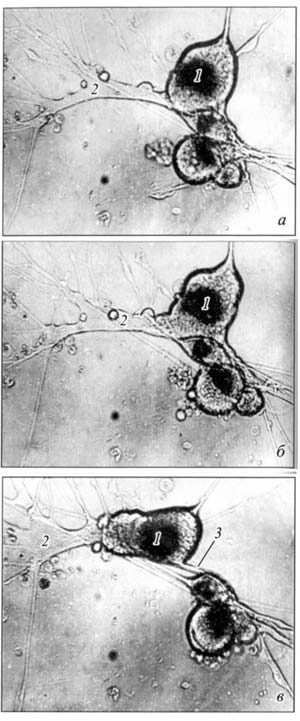
Сходным образом у всех исследованных животных выглядит и колба ретракции на конце отростка, которая свидетельствует о наличие процесса втягивания нейроном своего отростка. Этот процесс всегда наблюдается при повреждении нервного волокна, как у беспозвоночных, так и у позвоночных животных. Оба процесса происходят также при формировании нервных сплетений. Движение клеточного материала по тонким отросткам всех нейронов сопровождается появлением вдоль отростков варикозных расширений. Нейроны и рецепторные клетки перемещаются путем передвижения своих тел по своим отросткам (рис. 18, 19, 20). В ходе эволюции у всех животных с помощью такого перемещения идет погружение рецепторных клеток под эпителий, а также формирование нервных сплетений и ядерных центров – ганглиев (Зайцева, 1998, 1999, 2000, 2004, 2016; Зайцева и др., 2007, 2009). |

Рис. 1. Первое изображение живого мякотного (покрытого миелиновой оболочкой) нервного волокна (по: Leeuwenhoek, 1719).
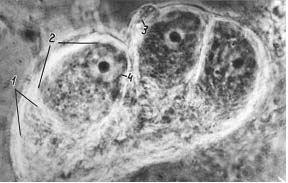
Рис. 3. Трехнейронный ганглий внутри блуждающего нерва лягушки. 1 – синаптическая зона; 2 – нуклеарная зона; 3 – глиоцит; 4 – ядро. Фазовый контраст (фото Сотникова).

Рис. 4. Маргинальные нервные и мышечные волокна интактного головного отдела ланцетника Amphioxus lanceolatus. Интактный препарат. Фазовый контраст (фото Сотникова).
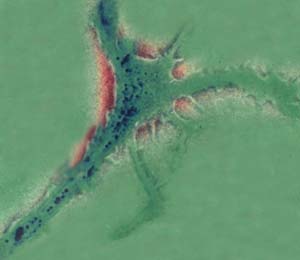
Рис. 6. Конус роста с митохондриями у нейрона моллюска Plenaris corneus. Культура нейронов. Цветной интерференционный контраст (фото Сотникова).

Рис. 7. Кольцевые синцитиальные анастомозы. Культура нейрона моллюска. Дифференциальный интерференционный контраст (фото Сотникова).
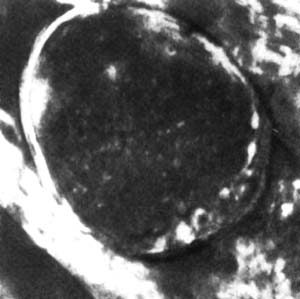
Рис. 9. Набухший синаптический аппарат лягушки при стимуляции. Прозрачный мочевой пузырь. Аноптральный микроскоп (фото Сотникова).
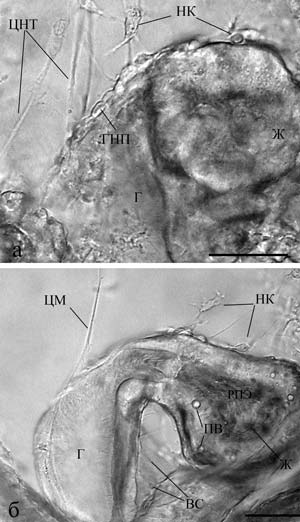
Рис. 16. Нервные клетки у пищеварительного тракта пилидия немертины (личиночное формирование нервной системы): а и б – пилидий размером 360 и 600 мкм соответственно. Реконструкция на основе послойной прижизненной микрофотосъемки. Видно формирование нервных отростков и конусов их роста – НК. Масштаб: 50 мкм. ВС – волокнистые структуры, Г – глотка, ГНП – глоточный нервный плексус, Ж – желудок, ЦМ – центральный мускул, ЦНТ – центральный нервный тракт, ПВ – пищеварительные вакуоли (по Зайцева, Флячинская, 2010).
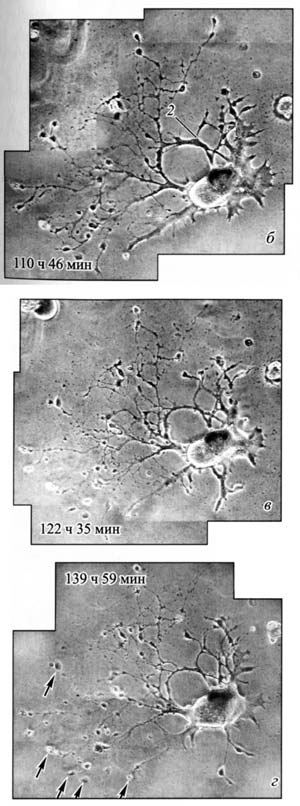
Рис. 18. Последовательные стадии процесса развития асимметрического сокращения дендритов одного и того же нейрона; наблюдается истончение отростков и образование множества колб ретракции с их последующей ампутацией (стрелки). Указано время от начала посадки в культуру. Фазовый контраст. Прижизненная серийная видеомикроскопия (по: Сотников, 2008).
|
Рекомендуемая литература |
|
|