Иммуногистохимические методы исследования нервной системы |
||
Решаемые задачи,
|
Возможность визуализации нервных клеток и их отростков с помощью иммуногистохимических методов основана на специфическом маркировании присутствующих в них особых химических веществ связанными с красителем антителами к данным химическим соединениям. К таким характерным для нервной системы химическим соединениям относится локализованный в большинстве отростков, а зачастую и в цитоплазме тел нейронов беспозвоночных и позвоночных животных, тубулин. Он присутствует в микротрубочках нейронов, образуя их микроскелет, а также в цилиарном аппарате эпителиальных и рецепторных клеток. Другими характерными для нейронов веществами являются секретируемые ими и содержащиеся в их телах и отростках регуляторные вещества, выполняющие роль нейротрансмиттеров, гормонов или нейромодуляторов. Среди таких веществ следует отметить ацетилхолин, ряд аминокислот (глутаминовая, гамма-аминомаслянная и др.), моноамины (серотонин и катехоламины – дофамин, адреналин, норадреналин и др.), энкефалины и огромное количество разнообразных и еще мало изученных нейропептидов (нейротензин, субстанция Р, FMRFамид и др.). В настоящее время к ряду из этих веществ получены специфические антитела, что позволяет выявлять их локализацию в нейронах и распределение такие клеток в различных отделах нервной системы. Достоинством всех иммуногистохимических методов является:
К недостаткам (ограничениям) иммуногистохимических методов относится:
|
Содержание
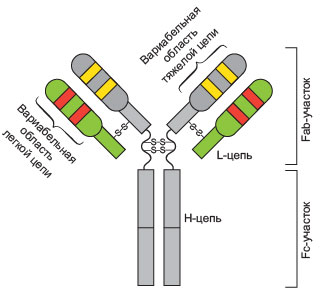
Упрощенная схема молекулы антитела. Молекула имеет форму буквы Y и состоит из двух идентичных тяжелых (H) цепей и двух идентчиных легких (L). На концах боковых ветвей (Fab-участков) расположены вариабельные антиген-связывающие участки.
|
Основные
|
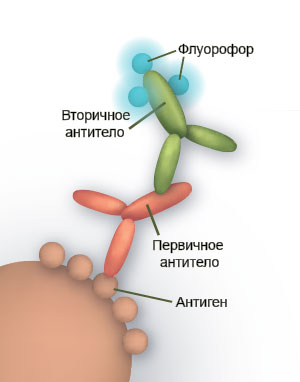
Иммуногистохимия – это комплекс методов исследования тканей, основанный на способности иммунной системы позвоночных (главным образом, млекопитающих и птиц) вырабатывать специфические белки – антитела, способные избирательно связываться с конкретными веществами (антигенами). В организме антитела используются, главным образом, для идентификации и нейтрализации патогенов. Особенность работы иммунной системы такова, что в теории антитела могут быть выработаны против практически любых химических соединений. Чем крупнее молекула антигена, тем быстрее и лучше будут вырабатываться антитела. Таким образом можно выработать антитела против интересующего вещества, выделить их из общей сыворотки и использовать для обнаружения этого вещества в клетках и тканях самых разных организмов. Методы иммуногистохимических исследований не новы. Начало им было положено в 30-е годы ХХ века, когда удалось получить меченные красителем антитела, которые реагировали с соответствующими антигенами и окрашивали их. В начале 40-х годов были получены антитела, конъюгированные с флуоресцентной меткой. Исследования проводились с использованием обычного флуоресцентного микроскопа. Появление же конфокального микроскопа значительно расширило возможности этого метода и позволив анализировать трехмерное строение интересующих структур. Антитела представляют собой гликопротеины, которые выделяют в особую группу иммуноглобулинов. Молекулы антител состоят из пары одинаковых тяжелых и пары одинаковых же легких полипептидных цепей. Соответственно, каждая молекула антител содержит два одинаковых антигенсвязывающих участка, распознающих соответствующий антиген и связывающийся с ним. Антитела вырабатываются В-лимфоцитами, при этом каждая отдельная линия В-лимфоцитов производит лишь один тип антител, распознающих один определенный эпитоп. Вследствие этого антитела принято делить на моноклональные (произведенные одной единственной линией клеток и распознающие один-единственный эпитоп) и поликлональные (произведенные лимфоцитами различных линий и распознающих, предположительно, различные эпитопы, предположительно одного антигена). Моноклональные антитела более специфичные, чем поликлональные, однако производство их обходится существенно дороже. Поэтому чаще всего для исследовательских целей используют поликлональные антитела. Сами по себе антитела не окрашены и не обладают способностью к флуоресценции. Существует несколько различных способов визуализации в иммуногистохимии, основывающихся на присоединении флуоресцентной или хромогенной метки к молекулам антител. Метка пришивается непосредственно на антитела, выработанные против конкретного антигена. Существует другой способ – так называемый непрямой иммуногистохимический метод. Он более чувствителен и гибок в работе. Заключается он в использовании двух различных антител: первичных и вторичных. Первичные антитела вырабатываются против конкретного антигена, который необходимо детектировать. Это – чистые, ни с чем не конъюгированные антитела. Вторичные же антитела вырабатываются против белков организма, из которого были получены первичные антитела. К ним и присоединяются молекулы-метки. В ходе реакции вторичные антитела находят прикрепленные к антигену первичные антитела и связываются с ними. Для выполнения метода образец сначала инкубируют с первичными антителами, а затем с вторичными. Данная методика не только более чувствительна, но также позволяет использовать с одними и теми же первичными антителами различные метки для различных ситуаций. Вторичные антитела с одним типом метки можно использовать с различными первичными антителами. Следует лишь учитывать, что первичные антитела должны быть произведены в животных того вида, против которого выработаны вторичные антитела. Один и тот же объект можно маркировать антителами против нескольких различных антигенов. Количество их, в теории, ограничено лишь количеством видов животных-хозяев, против которых вырабатываются вторичные антитела и спектральными характеристиками красителей. Следует помнить, что если первичные антитела против различных веществ были выработаны в животных одного и того же вида (например, в кроликах), то использовать их в одном эксперименте невозможно. Связано это с тем, что при дальнейших обработках, одни и те же вторичные антитела свяжутся со всеми первичными антителами и понять, какие вещества в итоге будут выявлены, станет невозможным. Кроме того, не следует использовать в одном эксперименте различные вторичные антитела с флуоресцентными метками, имеющими одинаковые или очень схожие спектры поглощения/эмиссии – это может привести к сложности или даже полной невозможности качественного разделения флуоресцентных сигналов. Метка флуоресцентными антителами хорошо сочетается с большинством часто используемых флуоресцентных методик, таких как мечение фибриллярного актина фаллоидином или окраска ядер красителем DAPI. Кроме того, можно комбинировать методы флуоресцентной иммуногистохимии с хромогенными методами детекции, используемыми при РНК-гибридизации in situ. Поскольку антитела – довольно крупные молекулы (IgG имеет молекулярную массу около 150 кДа), иногда может возникнуть проблема доставки их внутрь клеток, да и вообще внутрь организма. Для решения этой проблемы обычно используют две группы подходов. Первая группа подходов заключается в незначительном повреждении мембран исследуемого образца с использованием детергентов. Обычно для этих целей используется Triton X-100 в концентрации от 0,05% до 5%. Наиболее часто используемая концентрация – 0,1%. В некоторых случаях, при работе с организмами, имеющими плотную кутикулу, такими как нематоды или членистоногие, необходимо механическое повреждение кутикулы. Повреждения можно нанести механически, например скальпелем, либо непродолжительным воздействием ультразвука. Также в некоторых случаях можно применять предварительную ферментативную обработку объектов с использованием протеаз, хитиназ или коллагеназ. Альтернативная группа подходов заключается в уменьшении размера самих молекул антител. Тяжелые цепи имеют так называемый шарнирный участок, по которому при помощи фермента папаина можно разрезать молекулу антитела на три фрагмента: два Fab-фрагмента (непосредственно антиген-связывающие фрагменты – fragment antigen binding) и один Fc-фрагмент (фрагмент способный к кристаллизации – fragment crystallizable). Fab-фрагменты гораздо легче проникают внутрь клеток. Такой вариант чаще всего используется при нефлуоресцентной детекции, когда вместо молекулы флюорофора к фрагменту антитела пришивается фермент щелочная фосфатаза. Данный вариант детекции используется главным образом при проведении РНК-гибридизации in situ. |
|
Общее описание методик |
Иммуногистохимическое маркирование – сложный многоступенчатый процесс. Тем не менее, при должной аккуратности и точности в работе легко достичь стабильно воспроизводимых качественных результатов. В ряде случаев антитела могут неспецифически связываться с некоторыми веществами. Кроме того, зачастую объект исследования может обладать собственной флуоресценцией. Именно поэтому для процедур с антителами всегда следует ставить набор контролей для выявления возможного неспецифического окрашивания. В первую очередь, следует сделать отрицательный контроль как для первичных, так и для вторичных антител. Он необходим для выявления возможной автофлуоресценции и неспецифического связывания антител. Также, для того, чтобы понять, насколько хорошо прошла реакция, необходимо наличие положительного контроля. Сделать его можно посредством проведения иммуногистохимической реакции с уже исследованным ранее организмом с известным паттерном связывания антител. В ряде случаев положительный контроль можно заменить одновременным использованием нескольких различных первичных и вторичных антител. В случае успешного прохождения реакции результат мечения одними антителами будет выполнять функцию положительного контроля для других антител и наоборот. В иммуногистохимии качество связывания антител сильно зависит от качества фиксации. Классическим и наиболее часто употребимым фиксатором является 4% раствор формальдегида на фосфатно-солевом буфере. Принципиально важным для получения хороших результатов является качество фиксатора. Формальдегид в водных растворах постепенно превращается в муравьиную кислоту, метанол и ацетон, которые ухудшают фиксацию, поэтому для достижения лучших результатов фиксатор должен быть по возможности свежим. Лучший вариант – использовать фиксатор сразу после приготовления. В холодильнике можно хранить его в течение недели. Более длительное хранение возможно, но не рекомендуется. Иногда, для более длительного хранения фиксатора, готовят стоковый 16% раствор на воде и стабилизируют его метанолом (примерно 1 мл на 500 мл фиксатора). В таком виде стоковый раствор хранится в течение нескольких месяцев. |
|
Приготовление фиксирующего раствора параформальдегида |
Формальдегид в нормальных условиях представляет собой газ. Для приготовления 4% раствора формальдегида в лабораторной практике используют параформальдегид – продукт полимеризации формальдегида, имеющий вид белого порошка. Для получения хорошего фиксатора важно использовать по возможности наиболее чистый параформальдегид. Лучше всего использовать параформальдегид, специально предназначенный для этих целей. Параформальдегид распадается на мономеры при нагревании. Нагревать смесь следует постепенно, при постоянном перемешивании, избегая закипания. Лучше всего использовать для этой цели магнитную мешалку. Хорошо приготовленный фиксатор не должен содержать осадка и иметь нейтральную рН. При приготовлении фиксатора pH раствора понижается, что замедляет реакцию деполимеризации. В случае приготовления фиксатора на буфере или на морской воде буферной емкости системы обычно достаточно для поддержания нейтрального pH и весь параформальдегид должен раствориться самостоятельно. При приготовлении фиксатора на дистилляте (особенно это важно при приготовлении растворов более высокой концентрации) обычно требуется добавление по каплям 1Н раствора NaОН для нейтрализации. При этом следует контролировать pH раствора с помощью индикаторной бумаги, он должен оставаться близким к нейтральному. После приготовления фиксатор следует охладить и хранить в холодильнике. |
!
ВАЖНО: Формальдегид – сильный яд, потенциальный канцероген и обладает чрезвычайно неприятным резким запахом. При работе с ним следует соблюдать известную осторожность: работать в защитных перчатках, желательно в специальной одежде. Все манипуляции с раствором формальдегида и параформальдегидом следует проводить в вытяжном шкафу или вне помещений.

Конфокальный лазерный сканирующий микроскоп Leica TCS SP5 (Зоологический институт РАН, Центр коллективного пользования "Таксон"). Конфокальные микроскопы используются для сканирования препаратов, окрашенных конъюгированными с флуорохромами антителами и другими флуоресцентными красителями.
|
Иммуногистохими-ческое окрашивание материала |
Анестезированных животных фиксируют раствором, имеющим температуру окружающей фиксируемый объект среды, либо холодным фиксатором (охлажденным на льду). Как и при гистологической фиксации, желательно, чтобы соотношение объема фиксируемого объекта (а для водных организмов + объем воды, в котором они находятся на момент фиксации) к фиксатору составляло не менее 1:10. Оптимальные результаты дают фиксации в соотношениях от 1:20 до 1:40. Время фиксации и температурный режим для каждого конкретного вида могут варьировать, но обычно не превышают 24 часов. Чем крупнее объект, тем длительнее должна быть фиксация, поэтому следует избегать фиксирования чрезмерно крупных объектов (более 1 см в диаметре). Мелкие объекты, такие как личинки водных беспозвоночных, длиной до 500–1000 мкм можно фиксировать в течение двух часов при комнатной температуре или при +4°C. Более крупные организмы следует фиксировать в течение 4–6 часов при комнатной температуре, либо 8–12 часов при +4°C. Чрезмерно длительная фиксация приводит к ухудшению результатов. По истечении времени фиксации образцы следует отмыть в буферном растворе, обычно том, на котором был сделан фиксатор, либо на 0,1М фосфатно-солевом буфере с рН 7,2–7,4. Время отмывки может несколько варьировать в зависимости от размеров и свойств объекта. Желательно сделать не менее трех смен отмывочного буфера, продолжительностью около получаса каждая. Отмытый от фиксатора объект можно хранить в течение небольшого времени (в отдельных случаях до недели) в отмывочном буфере при +4°C. Для более длительного хранения в отмывочный буфер добавляют 0,01–0,1% азида натрия. Тем не менее, некоторые объекты все равно довольно быстро мацерируют. В этом случае следует либо по возможности быстро переходить к дальнейшим процедурам, либо перевести образцы в 70% этанол или в чистый метанол и хранить при -20°C или ниже. Отмытый, не содержащий следов фиксаторов образец можно использовать для дальнейшей работы. Первый важный этап иммуногистохимического окрашивания – преинкубация в растворе сыворотки или сывороточного альбумина. Преинкубационный раствор блокирует неспецифические сайты связывания в тканях исследуемого организма. Таким образом происходит существенное уменьшение последующего неспецифического связывания первичных и вторичных антител. Лучше всего использовать сыворотку, полученную из животного того вида, в котором были произведены вторичные антитела. Такая сыворотка максимально эффективно блокирует возможную неспецифическую активность и в то же время не будет проявлять кроссреактивности по отношению ко вторичным антителам. Обычно используется 5–20% раствор сыворотки на буфере. В качестве альтернативы сыворотки можно использовать раствор бычьего сывороточного альбумина на буфере в концентрации от 0,25 до 2,5%. Желательно проводить преинкубацию в холодильнике. Время преинкубации от 1,5 часов до суток. Чистую сыворотку следует разаликвотировть на небольшие объемы и заморозить. Раствор сывороточного альбумина лучше всего готовить непосредственно перед преинкубацией, либо хранить готовый раствор в холодильнике с добавлением в него 0,05–0,1% азида натрия. Хорошие результаты дает использование в составе буфера вместо Triton X-100 другого детергента – Tween 20. Он не так сильно повреждает мембраны, а также способствует более специфичному связыванию антител. После преинкубации можно приступать непосредственно к инкубации с антителами. Буфер для антител используется тот же, что и для отмывки от фиксатора. Иногда буфер для разведения антител содержит сыворотку, использованную для преинкубации или бычий сывороточный альбумин. Для большинства беспозвоночных животных использовать при инкубации с антителами сыворотки я лично считаю излишним. Оптимальную концентрацию антител следует для каждой партии подбирать индивидуально. Для этих целей нужно сделать серию последовательных разведений от 1:100 до 1:10000 (например, 1:100, 1:200, 1:500, 1:1000, 1:2000 1:5000 и 1:10000) и на основании полученных результатов в дальнейшем использовать ту концентрацию, с которой получился наилучший результат. Иногда фирма-производитель может указывать оптимальное разведение, однако и в этом случае я рекомендую в начале все же делать пробную серию разведений, поскольку в некоторых случаях активность антител может сильно варьировать даже от партии к партии. Время инкубации и температурный режим тоже могут варьировать в зависимости от свойств исследуемого объекта. В общем случае инкубация с антителами занимает не менее 16 часов (ночь) и проводится при +4°С. В случае необходимости время инкубации может быть увеличено до трех суток. Альтернативный вариант – инкубация 16 часов при комнатной температуре, также дающий хорошие результаты. По окончании инкубации необходимо убрать не связавшиеся антитела. Обычно достаточно трех последовательных отмывок буфером по 15–20 минут. После отмывки можно приступать к инкубации с вторичными антителами. Оптимальное разведение вторичных антител обычно указывается производителем. Время инкубации с вторичными антителами обычно такое же, как и с первичными, либо чуть меньше. Отмывка от вторичных антител осуществляется так же, как и от первичных. После инкубации с вторичными антителами образцы можно дополнительно докрасить фаллоидином и ядерным красителем (например, DAPI) и заключить в глицерин, мовиол или другую среду для флуоресцентной микроскопии. |
|
Протокол непрямого иммуногистохимичес-кого маркирования |
Данный протокол подходит для большинства морских Lophotrochozoa.
|
|
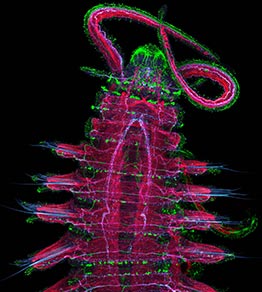
Иммунохимическое маркирование нервной системы личинок LophotrochozoaАвтор |
Нейроны выявляют на тотальных препаратах непрямым иммуноцитохимическим методом в модификации, оптимальной для соответствующих эмбрионов. Перед фиксацией личинок расслабляют (анастезируют) постепенным добавлением в раствор 50 мкМ MgCl2. Личинок фиксируют обычно 4–6 часов в 4% параформальдегиде в 0.01 M фосфатном буфере (ФБ, pH 7.4) при комнатной температуре или 8 ч при 10°С, затем тщательно промывали в ФБ (не менее 3 раз по 15 мин). Для длительного хранения личинок проводят по повышающемуся ряду спиртов (30-50-70% метанол с ФБ), финально помещая в 70% метанол, и хранят при -20°C. Для иммунохимического маркирования фиксации доводят до комнатной температуры, проводят по понижающемуся ряду спиртов (70-50-30% метанола с ФБ) до ФБ (2 x 15 мин). Места неспецифического связывания вторичных антител блокируют инкубацией в растворе, содержащем 10% нормальной сыворотки (того животного, в котором вырабатывались вторичные антитела, чаще всего используют козью сыворотку), 0.25% бычьего сывороточного альбумина (БСА), 1-5% Triton X-100 (TX), и 0,03% азида натрия в ФБ в течение ночи при 10°C. Затем препараты инкубируют в растворе первичных антител против соответствующего вещества. Рабочее разведение составляет для а5HT и аFMRFa 1:2000, ацетилированного α-тубулина – 1:3000. Антитела разводят в блокирующем растворе. Инкубацию проводят в течение двух-трех дней при 10°C. Затем препараты промывают в ФБ (3 x 20 мин) и инкубируют в растворе соответствующих вторичных антител, конъюгированных с Alexa (например, в антителах против кролика и против мыши, конъюгированных с Alexa 448, Alexa 546, Alexa 633, Molecular Probes), разведение 1:600 в ФБ с 0,1% TX в течение ночи при 10°C. Затем препараты промывают в ФБ (3 x 20 мин), помещают в 50% глицерин в ФБ на один час и заключают на предметные стекла в 80% глицерин в ФБ. При необходимости, в последнюю промывку перед монтированием препаратов добавляют ядерный маркер DAPI или пропидиум иодид (10 мкг/мл). Для двойного мечения против FMRFa и серотонина препараты инкубируют последовательно с аFMRFa (1:2000, 3 дня при 10°C), goat-anti-rabbit Alexa 488 IgG (1:300, ночь при 10°C), а5HT (1:3000, ночь при 10°C) и goat-anti-rabbit Alexa 546 IgG (Molecular Probes, 1:300, 5 часов при 10°C). После каждой инкубации проводят промывку в ФБ (3 x 30 мин). Обратный порядок инкубации в первичных антителах (анти-серотонин, затем анти-FMRFa) может привести к другому характеру окрашивания. |
|